2019年10月18日掲載
白楽の意図:本当は、キャサリン・イーバン(Katherine Eban)のジェネリック医薬品(後発医薬品)のねつ造・改ざんを暴いた著書・『Bottle of Lies: The Inside Story of the Generic Drug Boom』(2019年5月出版)を読み解きたかった。しかし、無料閲覧できないので、本ブログの方針に合わない。イーバンの著者を解説した「2019年5月のCBS News」記事を紹介する。
【追記】
・2019年10月23日の京都新聞:後発医薬品から発がん性物質、約5千箱回収 胃潰瘍や十二指腸潰瘍の薬
ーーーーーーー
目次(クリックすると内部リンク先に飛びます)
1.論文概要
2.書誌情報と著者
3.日本語の予備解説
4.論文内容
5.関連情報
6.白楽の感想
7.白楽の手紙
8.コメント
ーーーーーーー
【注意】「論文を読んで」は、全文翻訳ではありません。ポイントのみの紹介で、白楽の色に染め直してあります。
●1.【論文概要】
論文に概要がないので、省略。
●2.【書誌情報と著者】
★書誌情報
- 論文名:Allegations of widespread fraud raise questions about the safety of generic drugs made overseas
日本語訳:広範な虚偽があったという告発が、海外で製造されたジェネリック薬の安全性に関する疑問を提起している - 著者:不明
- 掲載誌・巻・ページ: CBS NEWS
- 発行年月日:2019年5月10日
- 引用方法:
- DOI:
- ウェブ:https://www.cbsnews.com/news/generic-drugs-manufactured-overseas-may-not-be-as-safe-as-you-think/、(保存版)
- PDF:
【動画1】
動画:「Bottle of Lies: How Poor FDA Oversight & Fraud in Generic Drug Industry Threaten Patients’ Health – YouTube」(英語)38分03秒。
Democracy Now!が2019/05/20
【動画2】
動画:「Many Indian drug companies putting profit over patients’ health: Katherine Eban – YouTube」(英語)12分51秒。
The Economic Timesが2019/07/10
●3.【日本語の予備解説】
後発医薬品(こうはついやくひん)、ジェネリック医薬品(英: generic drug, generic medicine)とは、先発医薬品の独占的販売期間の終了後に発売される、先発医薬品と同じ有効成分で効能・効果、用法・用量が原則同一であり、先発医薬品に比べて低価格な医薬品である。
日本における後発医薬品の普及率は、76.5%(2018年8月。数量ベース)となり、欧米と同等の普及率となっている。なお、アメリカ82%、イギリス81%、ドイツ79%、カナダ70%、オランダ69%、デンマーク54%、オーストラリア50%となっている(2013年・数量ベース)。
★2007年7月23日:クリニック西川:ジェネリック(ゾロ)の嘘
出典 → ココ
日本のジェネリック医薬品はけっして「同じ成分で同じ効果ではありません」。
同じなのは薬の中にはいっている主成分だけです。それ以外の成分は同じではありません。
1錠の薬の中には主成分だけが入っているわけではないのです。わずか数mgあるいは数百mgの主成分だけでは、飲みやすい形の剤型は作れません。
・・・中略・・・
実際に、「同じ効果」とうたっているジェネリック医薬品に代えたところ、前飲んでいた薬よりも効かなかったために、また先発医薬品に戻してもらう患者さんは少なくありません。
★xxxx年x月xx日:ウェルネスコラム:ジェネリック薬の嘘
私は、新薬の臨床試験を行っています。最近、逆流性食道炎の薬の臨床試験を行いました。
私が臨床試験を行ったのは、難治性といって通常の治療では治らない食道炎です。臨床試験では、まず難治性であるかどうかを見極めなくてはなりません。
そこで、食道炎が見つかった人に2ヵ月間、通常の治療薬(プロトンポンプ阻害剤)を飲んでもらいました。その後、内視鏡検査をして、治っていなければ難治性と判断して臨床試験に入ります。
ところが、2ヵ月間、先発薬を飲んでもらうと、全員が治ってしまいました。1例も難治性になりません。これでは、臨床試験ができません。
そこで一計を案じました。先発薬ではなく、ジェネリック薬を2カ月間飲んでもらうことにしたのです。すると、どうでしょう。治らない人が出てきました。これで臨床試験に入ることができたのです。これだけを考えても、先発薬とジェネリック薬の作用が異なるのは明らかです。
ジェネリック薬は、先発薬のメーカーが公開するデータに基づいて薬を作るわけですが、先発薬のメーカーがそのすべてを公開するわけがありません。肝心のところはぼかしているのです。
[白楽注:医師は患者の治療を最優先にすべきで、臨床試験をするために病気のままにしておくのは医療倫理に違犯すると思う。ここでは、ジェネリック薬の有効性に問題があるという指摘がされていたので引用した]
●4.【論文内容】
●《1》序論
米国民のすべてが「ジェネリック薬(後発医薬品)はブランド薬(先発薬)と同じです」という言葉を聞いたと思う。
ジェネリック薬は先発薬と同じ有効成分を含んでおり、メーカーは先発薬と同じように機能することを証明することになっている。 ただし、米国では、これらのジェネリック薬の多くは海外から輸入されており、有効成分の80パーセントと完成薬の40パーセントは米国外から輸入されている。
米国外で製造されたこれらのジェネリック薬は先発薬と同じ効能があるのか?
●《2》セドリック・ブラウン(Cedric Brown)
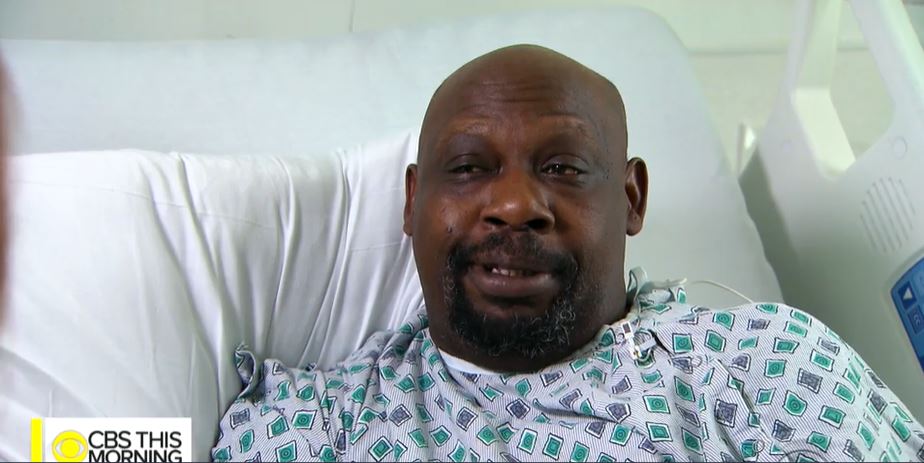
7年前、セドリック・ブラウン(Cedric Brown、上の写真、出典)は、心臓移植を受け、手術は成功し退院した。しかし、数か月後、ブラウンの状態は悪化し、クリーブランド病院(Cleveland Clinic)に戻った。
 クリーブランド病院の主治医のランドール・スターリング医師(Dr. Randall Starling、写真出典)は、ブラウンの身体が移植した心臓を拒絶していることに気が付いた。 スターリング医師は、ブラウンが服用していた先発薬のプログラフ(Prograf)と呼ばれる拒絶反応防止薬が、インドで製造されたジェネリック薬に切り替えられたことを知った。
クリーブランド病院の主治医のランドール・スターリング医師(Dr. Randall Starling、写真出典)は、ブラウンの身体が移植した心臓を拒絶していることに気が付いた。 スターリング医師は、ブラウンが服用していた先発薬のプログラフ(Prograf)と呼ばれる拒絶反応防止薬が、インドで製造されたジェネリック薬に切り替えられたことを知った。
米国・食品医薬品局(FDA)は、「ジェネリック薬は、投与量、安全性、品質において先発薬と同じです」と述べている。 しかし、クリーブランド病院の専門家は、一部のジェネリック薬は性能に問題があると判断している。一部の患者にとっては、薬物のわずかな変動でも深刻なリスクをもたらす。
「拒絶反応のリスクが高い特定の患者では、いかなる余裕もありません」とスターリング医師は述べている。
ブラウンは、先発薬に戻った途端、健康状態が改善した。
しかし、調査記者のキャサリン・イーバン(Katherine Eban)は、ブラウンが経験したことは大きな問題への入口であり、キャサリン・イーバンは過去5年間、この問題を調査してきたと述べている。
●《3》キャサリン・イーバン(Katherine Eban)の本

 キャサリン・イーバン(Katherine Eban、写真出典)は、『Bottle of Lies: The Inside Story of the Generic Drug Boom』(2019年5月)の著者である(表紙写真はアマゾン)。本は部分的に無料閲覧できるが、基本的には有料である。白楽は読んでいない。
キャサリン・イーバン(Katherine Eban、写真出典)は、『Bottle of Lies: The Inside Story of the Generic Drug Boom』(2019年5月)の著者である(表紙写真はアマゾン)。本は部分的に無料閲覧できるが、基本的には有料である。白楽は読んでいない。
米国がジェネリック薬を承認するために製薬会社から提出された情報に依存している。キャサリン・イーバンは、一部の海外メーカーのその情報にウソがあると述べている。
「業界にはデータを改ざんしている多くの企業があります」。
「改ざんを一掃せよ!」とキャサリン・イーバンは主張する。
最初の大きな事件は14年前に明らかになったインドのジェネリック薬メーカー・ランバクシー・ラボラトリーズ社(Ranbaxy)の事件でした。
→ 企業:特許切れ医薬品(off-patent drugs、ジェネリック医薬品、generic drugs):ランバクシー・ラボラトリーズ社(Ranbaxy Laboratories)(インド) | 研究者倫理
同社は、「不良医薬品」の販売および「米国・食品医薬品局(FDA)へねつ造・改ざん書類の提出」を行なったため、2013年、和解の一環として、50億ドル(約5,000億円)の罰金を支払った。ランバクシー・ラボラトリーズ社の元・重役だったディネッシュ・タクール(Dinesh Thakur)が事件の内部告発者だった。
ディネッシュ・タクールは、「ねつ造・改ざんしている製薬会社はランバクシー・ラボラトリーズ社だけではありません。2013年以来、他の製薬会社でも同様のネカトを見てきました」述べている。
キャサリン・イーバンは、海外の医薬品を規制する米国・食品医薬品局(FDA)の規制力に主要な問題があると指摘している。
「医薬品生産供給システムの全体が変化しました。現在、医薬品生産供給拠点は海外にあり、米国・食品医薬品局(FDA)はグローバルに対処することを余儀なくされています。問題は、その対処の仕方です」
「対処はうまくできていますか?」と尋ねると、キャサリン・イーバンは「非常に悪いです」と答えた。
米国・食品医薬品局(FDA)の検査官は、事前告知ナシで海外の製薬工場に立ち入り検査をするが、当の製薬工場は数週間前に既に「検査官が来る」と感知していた。
「海外での立ち入り検査は、計画的検査です。だから、製薬企業が立ち入り検査の時期を推測できます。そして、それに対処する計画ができています」
米国・食品医薬品局(FDA)は、「世界中のすべての先発薬およびジェネリック薬の製造施設を検査する」と声明(次項)で述べているが、怪しいもんだ。
食品医薬品局(FDA)の元・捜査官は、表面的な検査では問題は見つからない。「製薬企業の記録をさらに掘り下げて調査すると、ねつ造・改ざんなどの深刻な問題が見つかってきました」とCBS News記者に語った。
その元・検査官が提出した報告書には、多くのジェネリック薬メーカーが記録をねつ造・改ざんし、製造上の問題を隠蔽し、貧弱な医薬品テスト結果を隠そうとしたことを示していた。そのため、彼は「それらの医薬品の安全性と有効性は疑問である」と述べた。
これらの検査報告は、前出のクリーブランド病院のスターリング医師にとって最悪のニュースだった。「私の最初の反応は怒りです。情報をねつ造・改ざんして、医薬品を製造し、利益を上げる。そんなことが起こっているのとは、にわかに信じがたい」と彼は言った。
なお、ジェネリック医薬業界はキャサリン・イーバンの主張に同意していない。ジェネリック薬業界は、「毎年、数億ドル(数百億円)を寄付して米国・食品医薬品局(FDA)の検査を支援している。米国・食品医薬品局(FDA)の医薬品チェック体制に欠陥があれば、米国民の健康に深刻な問題が発生するだろう」と述べている。
キャサリン・イーバンは指摘する。
問題の1つは、医薬品に関する公開情報が不足していることだ。処方されたジェネリック薬はどの製薬会社が作ったかを薬剤師に尋ねることはできる。しかし、その製薬会社がかつて医薬品をリコール(不良品回収)したか、また、医薬品で何らかの問題を起こしたかを調べるには、公開情報だけで知るのは困難である。それなりの調査が必要になる。
もう1つの問題は、また、製薬会社が実際に医薬品を製造している場所を見つけることは、不可能ではないにしても非常に困難である。米国・食品医薬品局(FDA)は、連邦法の下では「機密情報」と見なされていると述べている。
●《3》食品医薬品局(FDA)の声明
 米国・食品医薬品局(FDA)の薬物評価研究センター長(Director of FDA’s Center for Drug Evaluation and Research)のジャネット・ウッドコック(Janet Woodcock)(写真出典同)の声明を以下に示す。
米国・食品医薬品局(FDA)の薬物評価研究センター長(Director of FDA’s Center for Drug Evaluation and Research)のジャネット・ウッドコック(Janet Woodcock)(写真出典同)の声明を以下に示す。
患者を保護することは食品医薬品局(FDA)の最優先事項であり、FDAが承認する製品の品質に自信を持っています。ジェネリック薬がブランド薬(先発薬)と同等の安全性と有効性を確保するために、複数の措置を講じています。
医薬品が米国で製造されているか、海外で製造されているかにかかわらず、FDAは、米国市場向けの製品を製造する世界中のすべてのブランド薬およびジェネリック薬の製造施設を検査し、製造プロセスに関するFDAの要件を満たしていることを確認しています。医薬品の製造は長年にわたって世界的になってきたため、場所を問わず、企業が米国患者向けの高品質で安全かつ効果的な医薬品を製造するためのFDAの厳格な基準を満たすように方針を改訂しています。
FDAの世界的な取り組みは、データの整合性の問題と製造上の問題を防止・発見・対処するため、リスクの高い施設に焦点を当てています。 リスクを基準にしたサイト選択監視検査モデルを使用し、慎重に選択した複数の要因に基づいて、国内および国外の検査箇所に優先順位を付けています。
過去数年にわたって、FDAは国外の製造施設で多数の抜き打ち検査を実施してきました。内部告発者からの情報がある場合、またはFDAが薬物安全性の問題を調査している場合の重要な検査です。また、業界、患者、医療提供者からのレポートを監視して、潜在的な品質問題を特定して解決します。
私たちは、世界的な医薬品サプライチェーンの潜在的な問題に対処・警戒し、米国民が医薬品の安全性と品質に自信を持てることを保証します。
●5.【関連情報】
① 2012年7月の「厚生労働省」記事:ジェネリック医薬品への疑問に答えます 〜ジェネリック医薬品 Q&A〜
ジェネリック医薬品(後発医薬品)とは、先発医薬品と同一の有効成分を同一
量含み、同一経路から投与する製剤で、効能・効果、用法・用量が原則的に同一であり、先発医薬品と同等の臨床効果・作用が得られる医薬品をいいます。研究開発に要する費用が低く抑えられることから、先発医薬品に比べて薬価が安くなっています。
ジェネリック医薬品を普及させることは、患者負担の軽減や医療保険財政の改
善に資することから、政府としても、2012(平成24)年度までに後発医薬品の数量シェアを30%以上にするという目標を掲げ、使用促進のための環境整備を進めているところです。
●6.【白楽の感想】
《1》日本政府
日本政府が「ジェネリック医薬品(後発医薬品)は先発薬を同じ効果」と広報・宣伝するのものだから、日本人は「ジェネリック医薬品は先発薬と同じ」と思い込まされている。
何故、日本政府がジェネリック医薬品を推奨するかと言えば、国民が薬を安く買うことで健康の一層の充実が図れるため、ではない。
日本政府は、国民の健康を無視して(は言い過ぎだが)、医療保険にかかる費用を減らすためにジェネリック医薬品(後発医薬品)の使用拡大を急速、かつ強力に推し進めているのだ。
キャサリン・イーバンが主張するように、米国で問題があるなら、日本で使用されているジェネリック医薬品の効能も問題があるだろう。安全性と効能をチャンとチェックして欲しいですね。
ナニナニ、ジェネリック医薬品の効能をチェックしたオレンジブックを日本でも、ウェブで公表していますだと?
オレンジブック(Approved Drug Products with Therapeutic Equivalence Evaluations – Wikipedia)の本家の米国で、キャサリン・イーバンが問題点を指摘しているんですよ。政府広報が信用できないという話ですよ。
《2》純正品と代替品
医薬品と限らず、純正品と代替品はその性能が同じか・違うか?
一般的には難しい問題だ。
純正品を製造販売するのは大手企業なので、代替品は性能が落ちると主張する。
一方、代替品は開発費・宣伝費がなく経費が安いので、良い品を安く販売できると代替品業者は主張する。
利害関係があるので、両者の主張は基本的には信用しにくい。
代替品の方がコストパフォーマンスで優れている印象がある一方、「安かろう悪かろう」の印象もある。
実は、純正品と代替品の比較、というように、その性能を一括りで判定するのが間違いなのだ。純正品に良い品と粗悪品があるように、代替品にも良い品と粗悪品がある。個々で判定するしかない。だから、純正品であれ代替品であれ、しっかり検査して欲しいということだ。
ーーーーーー
日本がもっと豊かに、そして研究界はもっと公正になって欲しい(富国公正)。正直者が得する社会に!
ーーーーーー
ブログランキング参加しています。
1日1回、押してネ。↓
![]()
ーーーーーー
★記事中の画像は、出典を記載していない場合も白楽の作品ではありません。
●8.【コメント】
注意:お名前は記載されたまま表示されます。誹謗中傷的なコメントは削除します